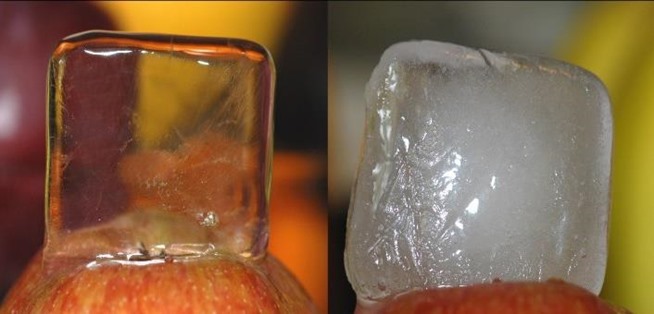
Warum ist Eis aus gekochtem Wasser klar?
dk2ax
Antworten (3)
Vorherige
Die kurze Antwort: Trübes Eis wird durch im Wasser gelöste Gase (hauptsächlich Stickstoff und Sauerstoff) verursacht, die aus der Lösung austreten, wenn das Wasser gefriert. Die im Eis eingeschlossenen kleinen Blasen verursachen das weiße Aussehen. Durch das Kochen des Wassers wird die darin gelöste Luft entfernt, wodurch klares Eis entsteht. Vorausgesetzt, andere Verunreinigungen erzeugen nicht den gleichen Trübungseffekt.
Die lange Antwort:
Verunreinigungen im Wasser:
Gase: Wasser bei 20 °C enthält normalerweise etwa 15 ppm gelöste Gase, was 1 Volumen Luft pro 50 Volumen Wasser entspricht. Dies sind die gleichen Gase, die in der Luft vorhanden sind, aber nicht in den gleichen Anteilen, da einige löslicher sind als andere: Es sind etwa 63 % Stickstoff, 34 % Sauerstoff, 1,5 % Argon und 1,5 % Kohlendioxid.
Mineralien: Leitungswasser enthält gelöste Mineralien, hauptsächlich Ca und Mg. Sie können in Form von Bicarbonaten vorliegen: und (diese existieren nur in Lösung, nicht als feste Substanzen) und als Calcium- und Magnesiumsulfat. Wenn das Wasser durch einen Wasserenthärter gelaufen ist, können die Ca- und Mg-Ionen durch (doppelt so viele) Natrium- oder Kalium-Ionen ersetzt worden sein.
Die Auswirkungen der Erwärmung des Wassers:
Entfernung gelöster Gase: höhere Temperatur begünstigt endotherme Reaktionen ( Prinzip von Le Chatelier ). Für die im Wasser vorhandenen Gase ist die Auflösung (bei Raumtemperatur) ein exothermer Prozess, sodass ihre Löslichkeit abnimmt, wenn das Wasser erhitzt wird. Die Löslichkeit von Gasen erreicht am Siedepunkt weder Null noch nimmt sie notwendigerweise über den gesamten Temperaturbereich ab. Für Stickstoff in Wasser wird die Auflösungsenthalpie um 75° positiv , und seine Löslichkeit nimmt oberhalb dieser Temperatur zu. Bei 100°C ist die Löslichkeit von Luft als Ganzes , etwa halbe Löslichkeit bei 10°C, .
Entfernung gelöster Mineralien: Das Erhitzen des Wassers fördert die Umwandlung von löslichen Ca- und Mg-Bicarbonaten in unlösliche Carbonate ( → ), die aus der Lösung (als Kalkablagerungen) austreten. Die Sulfate (manchmal als "permanente Härte" bezeichnet) und die Natrium- oder Kalium(bi)carbonate bleiben in Lösung.
Die Wirkung des Kochens:
- Die Löslichkeit von Gas in Flüssigkeit hängt nicht nur von der Temperatur ab, sie ist direkt proportional zum Partialdruck des Gases. Beim Kochen ist die mit dem Wasser in Kontakt stehende Gasphase nicht mehr die Luft, sondern der Wasserdampf (in den Blasen und nahe der Oberfläche). In diesen Blasen ist der Partialdruck der Gase nahe Null, so dass Gasmoleküle immer noch die flüssige Phase verlassen (und die vergrößerte Oberfläche und die Bewegung des Wassers beschleunigen den Prozess), aber kaum welche zurückkehren. Bei ausreichender Zeit wird der Wasserdampf den größten Teil des Gases entfernen. Kochen ist im Grunde das Äquivalent zum Entgasen durch Spülen: Entfernen eines Gases (normalerweise Sauerstoff) aus einem Lösungsmittel, indem ein inertes Gas hindurchgeblasen wird.
Wie machen Gase Eis „milchig/trüb“?
- Beim Gefrieren beginnt die Eisschicht an allen Seiten des Würfels und wächst nach innen. Wassermoleküle passen in das Kristallgitter und haften daran, andere Moleküle nicht (aber wenn das Eis schneller wächst als die Gasmoleküle wegdiffundieren können, werden sie eingeschlossen). Die Konzentration von Gasen (und anderen Verunreinigungen) in der verbleibenden Flüssigkeit steigt, die Lösung wird übersättigt, Mikrobläschen beginnen sich zu bilden. All diese werden im Eis eingeschlossen und geben ihm ein milchiges Aussehen.
dk2ax
Selene Rouley
Ich bin wirklich begeistert, denn das letzte Mal, dass ich eine Gleichgewichtsberechnung durchgeführt habe, war vor 35 Jahren! Aber ich bin mir einer Teilantwort ziemlich sicher (siehe Diskussion am Ende).
Die Löslichkeit eines Gases in Wasser (oder Flüssigkeiten im Allgemeinen) nimmt fast immer mit steigender Temperatur ab. Dieses Phänomen wird auf ähnliche Weise wie die Erklärung der Zunahme der Verdampfungsrate einer Flüssigkeit mit der Temperatur erklärt. Gase lösen sich in Flüssigkeiten auf, weil die Gasmoleküle einen niedrigeren Energiezustand an die Flüssigkeit gebunden vorfinden. Je höher die Temperatur, desto größer der Anteil der Gasmoleküle mit thermischer Energie, die größer ist als die Bindungsenergie für den Auflösungsprozess. So kann ein größerer Anteil der Gasmoleküle aus Flüssigkeit entweichen: Das chemische Gleichgewicht für die Lösungsreaktion verschiebt sich mit steigender Temperatur zugunsten freier Moleküle gegenüber gebundenen.
Das Sieden einer Flüssigkeit senkt die Konzentration gelöster Gase durch den oben genannten Effekt. Normalerweise würde die Verschiebung des Gleichgewichts zurück zu Gunsten gelöster Gase bei sinkender Temperatur bedeuten, dass die Flüssigkeit beim Abkühlen so viel Gas aufnehmen würde, wie beim Sieden ausgetrieben wird. Der Trick bei klarem Eis besteht darin, dass die Flüssigkeit zu schnell gefroren wird, als dass der Gasauflösungsprozess abgeschlossen werden könnte – sie wird irreversibel gefroren , so dass sie beim Abkühlen weit vom Gleichgewicht entfernt ist – mit dem Ergebnis, dass es zu einem Nettoausstoß von Gas kommt die Flüssigkeit durch das Kochen vor dem Gefrierprozess. Sobald die Flüssigkeit gefroren ist, kann sich das Gas nicht mehr darin lösen, sodass Sie klares Eis haben.
Beachten Sie, dass diese Antwort unvollständig ist: Sie beantwortet nicht, warum das in der Flüssigkeit gelöste Gas die Blasen bildet, die es beim Gefrieren der Flüssigkeit bildet, wie im rechten Bild Ihrer Frage. Diese Antwort erklärt nur das Fehlen des für den Trübungsprozess erforderlichen Gases. Eine vollständige Antwort muss also erklären, warum das gelöste Gas aus der Lösung austritt und beim Gefrieren von Eis Blasen bildet.
Vorherige
zwöl
Mike Scott
J...
JDługosz
Selene Rouley
Selene Rouley
Selene Rouley
J...
Neil
Xylius
dk2ax
Karel
Diese Antwort war als Kommentar zu @WetSavannahanimal alias Rad Vance gedacht, aber sie ist ziemlich lang und ich habe die Zeichengrenze erreicht.
Der Grund für das undurchsichtige Zentrum sollte in der Art und Weise liegen, in der das Wasservolumen gefriert. Vermutlich wird die Lösung nicht gemischt und die Außenseite friert zunächst ein und bildet eine kristalline (Eis-)Wand, durch die das Gas nicht entweichen kann. Wenn sich die Wand verdickt, wird Gas aus dem Wasser freigesetzt, das sich in der verbleibenden zentralen Lösung verfestigt. Dadurch wird das Gas in der verbleibenden Flüssigkeit im Zentrum konzentriert. Wenn die Gaskonzentration in dieser Lösung den Sättigungswert für die Flüssigkeit in ihrem aktuellen Zustand erreicht, tritt ein Teil davon aus der Lösung aus und bildet die Hohlräume, gleichzeitig sollte sich etwas Eis bilden und die Lösung auf die Sättigungskonzentration zurückführen. Dies wird wiederholt, bis das gesamte Wasser gefroren ist.
Die Beobachtung, dass durch klares Eis beim Gefrieren Gas sprudelt, deutet darauf hin, dass das Mischen der Lösung es den gesättigten Gasen ermöglicht, von der Oberfläche des gesamten Wasservolumens zu entweichen, wenn sich der Feststoff bildet, anstatt sich in der Mitte zu bilden.
Nun könnte man sich die Frage stellen, warum es nicht nur eine einzige Blase gibt. Der erste Grund, aus Sicht der Massenlösung, ist, dass das Wasser gefriert und dabei allmählich Blasen bildet. Es schwingt wirklich um den Gleichgewichtszustand der Lösung, also den Gassättigungspunkt der Gefrierlösung. Die genauen Bedingungen an diesem Punkt variieren leicht, wenn die Flüssigkeit gefriert. Der Druck, bei dem das Eis in der Mitte gefroren ist, ist wahrscheinlich größer als der Druck, bei dem beispielsweise das Oberflächeneis gefroren ist, ebenso kann die Temperatur, bei der es gefroren ist, ebenfalls variieren. Es gibt wahrscheinlich auch einen Konzentrationseffekt, das heißt, da sich dieser Gleichgewichtspunkt um den Gassättigungspunkt herum verschiebt, beeinflusst diese Konzentrationsänderung auch den Gefrierpunkt ein wenig. Während des Einfrierens spielen etwa vier Effekte (Temperatur, Druck, Volumen und Gaskonzentration) eine Rolle. Der zweite Effekt, vom Standpunkt des endlichen Volumens aus gesehen, besteht darin, dass das Wasser lokal um den Hohlraum herum einen "Gasstoß" erfahren könnte, der lokal einen Wasserfilm einfrieren könnte, der die Blase einkapselt, daher die endgültige komplexe Anordnung von Hohlräumen und nicht die Formation einer einzelnen Blase.
Jetzt ist es vielleicht möglich, diese Gefrierpunktunterschiede mit dem Polarisator-Trick zu sehen. Ich habe das bisher nur bei durchsichtigen Kunststoffen gesehen, aber es sollte auch hier funktionieren. Wenn Sie das nächste Mal ins Kino gehen, besorgen Sie sich eine 3D-Brille. Nehmen Sie die beiden Polarisationslinsen heraus und halten Sie sie auf beiden Seiten des Eiswürfels, indem Sie sie ein wenig drehen. Sie sollten die innere kristalline Struktur des Eises als ein Durcheinander von wirbelnden Linien sehen. Sie sollten wahrscheinlich eher einen Wirbel oder eine Streuung in der Mitte in der Nähe der Blasen sehen, was auf die lokalisierten Änderungen in der Kristallstruktur hinweist. Sie sollten dies mit dem transparenten Würfel vergleichen.
Es gibt noch einen weiteren Trick, den Sie ausprobieren können. Wenn Sie das Gefrieren des Eises bis zu einem gewissen Grad kontrollierten, konnten Sie die Bildung der Blasen kontrollieren. Zum Beispiel sind unsere Eiswürfelschalen aus Kunststoff und wir haben in der Regel eine durchsichtige obere Schicht mit Blasen, die sich im unteren Teil des Würfels bilden. Ich vermute, dass der Kunststoff seine Wärme behält und das Einfrieren des Bodens und der Seite des Würfels verzögert. Ich vermute, wenn man die Eisschale vor dem Formen des Eises erwärmt oder sogar gekühlt hat, könnte man eine andere Bildung von Hohlräumen sehen (wie im zweiten Bild hier gezeigtzum Beispiel). Wenn Sie eine Eisschale aus Metall verwendet haben, sollten Sie den beobachteten Effekt sehen. Wenn Sie eine Metall- und eine Kunststoff-Eisschale miteinander kombinieren, erhalten Sie möglicherweise mehr Blasen näher an der Kunststoffseite. Sie können sogar einen Punkt-/Explosions-/Kleckseffekt erzielen, indem Sie Klebstoff in eine Metallschale tupfen oder einen Metallstab in das Volumen halten, während Sie es einfrieren. Obwohl Sie nur Punkte hinzufügen könnten, damit sich das Gas bildet und entweicht, was zu klaren Würfeln führt. Alternativ können Sie auch einfach ein Carrat (Hut) bekommen . Dieser Bursche scheint einen Großteil der Beinarbeit für Sie erledigt zu haben. Wohltuend scheint er seine Experimente danach zu genießen (YMMV).
Wenn Sie wirklich interessiert sind, sollten Sie nachsehen, ob die NASA irgendwelche Gefrierexperimente im Weltraum durchgeführt hat, es könnte andere Methoden zeigen, mit denen man die Blasenbildung kontrollieren könnte. In ähnlicher Weise finden Sie möglicherweise Aufnahmen von Hochgeschwindigkeitskameras vom Einfrieren, bei denen Sie einige interessante Effekte sehen sollten, wenn sich Blasen bilden (obwohl es eine etwas widersprüchliche Verwendung dieser Kameras ist und ich bezweifle, dass die Leute, die sie besitzen, daran gedacht haben, sie für diesen Zweck zu verwenden ).
Erklärung des gefrorenen Taus
Warum platzt ein Rohr durch gefrorenes Wasser?
Thermodynamik von unterkühltem Wasser
Wie ist der Stand der Untersuchungen zum Mpemba-Effekt?
Warum ist mein flüssiges Soda eingefroren, nachdem ich es aus dem Kühlschrank genommen habe?
Eisflocken in gefrorener Milch und Orangensaft
Warum hält das Zerkleinern einer Wasserflasche das Wasser in einem sprudelnden Zustand? [Duplikat]
Warum gefriert das Auftreffen auf einen kalten Beutel mit Wasser?
Salzwasser und Eis im Vergleich zu normalem Wasser und Eis
Kann eine Flüssigkeit in einem geschlossenen Behälter sieden?
Steeven
dk2ax
Bakuriu
dk2ax
dk2ax
Paparazzo
dk2ax
Wahnsinnig
dk2ax
Vorherige
JDługosz
Benutzer10851
David Richerby
Jim
dk2ax
dk2ax
David Richerby
Jim