Was ist/sind die molekularen Unterschiede zwischen HDL- und LDL-Cholesterin?
JohnPhteven
Warum genau ist HDL-Cholesterin gut für uns und LDL-Cholesterin schlecht für uns? Es ist allgemein bekannt, dass LDL-Cholesterin mit Atherosklerose assoziiert ist und dass HDL-Cholesterin dabei hilft, überschüssiges LDL-Cholesterin aus dem Kreislauf zu entfernen. Was aber ist aus biochemischer Sicht der Unterschied zwischen den Molekülen, der diesen Unterschied verursacht?
Antworten (2)
Niko
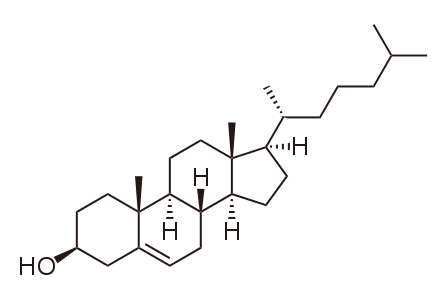
Zunächst einmal sollten wir präzisieren, dass es so etwas wie „HDL-Cholesterin“ und „LDL-Cholesterin“ nicht gibt . Ebenso gibt es kein „gutes Cholesterin“ und „schlechtes Cholesterin“ : Cholesterin ist nur ein Molekül mit dieser chemischen Struktur
Was Bluttests im Allgemeinen melden, ist HDL-C und LDL-C, das heißt die Menge an Cholesterin in HDL bzw. LDL (wiederum ist Cholesterin immer dasselbe Molekül, ob in einem HDL oder in einem LDL).
HDL (High Density Lipoprotein) und LDL (Low Density Lipoprotein) sind Lipoproteine , Ansammlungen von Proteinen und Lipiden, die unter anderem Cholesterin transportieren können. Es gibt 5 Haupttypen von Lipoproteinen, die als Chylomikronen , VLDL , IDL , LDL und HDL bezeichnet werden und sich durch ihre Größe, Dichte und die Proteine, aus denen sie bestehen, unterscheiden.
Die Hauptfunktion von Lipoproteinen besteht darin, Lipide (=Fette) im Blut durch den Organismus zu transportieren. Das Problem ist, dass Lipide nicht wasserlöslich sind (versuchen Sie, etwas Öl in ein Glas Wasser zu gießen) und Blut hauptsächlich aus Wasser besteht. Lipoproteine hingegen haben ein hydrophiles (= „wasserliebendes“) Äußeres und ein lipophiles (= „fettliebendes“) Inneres, etwa so:

Auf dem Bild stellen die „Bälle“ Proteine dar, die Apoproteine genannt werden, und das C stellt Cholesterin dar und T Trygliceride, die beide Lipide sind. Wie Sie sehen können, befinden sich alle Fette innerhalb des Lipoproteins, aber das Äußere, das wasserlöslich ist, kann leicht im Blut gelöst werden.
Die Biochemie von Lipoproteinen ist ziemlich kompliziert und ich werde hier nicht ins Detail gehen (aber hinterlassen Sie bitte einen Kommentar, wenn Sie weitere Erklärungen wünschen), aber um die Dinge zu vereinfachen:
- HDL bringt Lipide aus der Peripherie zurück zur Leber
- LDL bringen Lipide aus der Leber in die Peripherie
Es ist an dieser Stelle sehr wichtig festzuhalten, dass Lipide ein physiologisch wichtiger Bestandteil unseres Organismus sind. Alle Zellen in unserem Körper enthalten Lipide: Die Membran jeder Zelle im Körper besteht aus Lipiden (Phospholipide genannt) und enthält auch Cholesterin. Tatsächlich ist Cholesterin äußerst wichtig für das reibungslose Funktionieren des Körpers , da es beispielsweise als Grundlage für die Herstellung vieler Hormone dient (sogenannte Steroidhormone wie Östrogen, Progesteron, Cortisol, Testosteron usw.).
Zu hohe Lipidwerte, insbesondere Cholesterin, sind jedoch nicht vorteilhaft, da hohe Cholesterinwerte tatsächlich mit vielen Herz-Kreislauf-Erkrankungen in Verbindung gebracht werden, von denen wir heutzutage viel hören.
Da HDL dazu neigt, die Lipide aus dem Kreislauf zu entfernen und sie zurück in die Leber zu bringen, können sie als eine Art "Reiniger" betrachtet werden, die überschüssiges Cholesterin aus dem Kreislauf entfernen.
MCM
JohnPhteven
R Stefan
Niko
Peter Bernhard
Peter Bernhard
Ihre Frage bezieht sich auf die molekularen Unterschiede zwischen LDL und HDL.
Ihre Art zu formulieren, nach Unterschieden auf molekularer Ebene zu fragen, lenkt die Aufmerksamkeit auf die überraschende Tatsache, dass die molekulare Struktur gar nicht so unterschiedlich ist, wie die großen Unterschiede in der physiologischen Funktion vermuten lassen. Ihre Frage ist berechtigt, da Lehrbücher unterschiedliche Gehalte an Cholesterin, Triglyceriden und Proteinen auflisten, aber nicht auf Unterschiede in der Struktur von beispielsweise "molekularen Markern von LDL" eingehen. Ähnlich wie bei verschiedenen Klassen von Antikörpern (IgM, IgG, IgA...) scheinen alle Transporter-Lipoproteine eine sehr ähnliche Struktur zu haben.
Umgekehrt, um dies zu veranschaulichen, kann das Wort "Chylomikronen" dazu verleiten, diese als "Micellen" zu betrachten oder sich stark von den Lipoproteinen zu unterscheiden, die als HDL, LDL, IDL und VLDL bezeichnet werden. Sie gehören jedoch auch zur Klasse der Lipoproteine, deren Funktion der Transport von Lipiden ist, und sie sind in ihrer molekularen Struktur ähnlicher, als es die Kennzeichnung vermuten lässt.
Interessanterweise wurde eine ähnliche Frage zu Stackexchange Chemics auf Ihre Frage verwiesen. Das könnte das Obige veranschaulichen: Alle relevanten Unterschiede beziehen sich weder auf die Beladung der Lipoproteine noch auf ihre Unterschiede in Hüll- oder Kernproteinen (die existieren), aber jeder Unterschied liegt in der Biologie, die ironischerweise sehr viel mit "Markierung" übereinstimmt. : welches Lipoprotein im Gegensatz zu den anderen von welchem Organ stammt, welches man adressiert und an welcher Art von Zielzellen entlädt.
Zusammenfassend lässt sich sagen: Unterschiede sind weder Unterschiede in der Belastung noch im Fell, sondern Unterschiede in der Sende- und Empfangssignalisierung, die, wie sich herausstellt, Unterschiede von Apolipoproteinen sind.
Somit bindet der Ligand an LDL an
"LDL-Rezeptor"
ist der Hauptunterschied "buchstäblich",
was sich bemerkenswert in der Tatsache widerspiegelt, dass der LDL-Ligand auf LDL-Molekülen das größte bekannte Protein ist, genannt
Apo B-100.
Beantwortung Ihrer Frage: Es ist die Expression des Apo B-100-Proteins, das LDL von HDL auf molekularer Ebene hinsichtlich der Pathogenität unterscheidet.
Umgekehrt kann das apoA-I-Protein als Unterscheidungsmerkmal von HDL angesehen werden (siehe z. B. Zitat unten, Verghese et al.)
Überraschend ist außerdem die Tatsache, dass es nicht ein und dasselbe HDL- oder LDL-Molekül gibt, beide Begriffe bezeichnen Klassen von Proteinen; es scheint, dass kein einzelnes „LDL-Cholesterin“ wie jedes andere „LDL-Cholesterin“ ist. Siehe zum Beispiel Kontush et al., 2014 Structure of HDL: Particle Subclasses and Molecular Components.
Relevantes Merkmal dieser Proteine sind ihre Rezeptorligandenproteine.
Die Herunterregulierung der LDL-Rezeptoren ist die Hauptursache für Atherosklerose (keine bekannten anderen schädlichen Wirkungen von Cholesterin).
Von Nobelprize.org „Brown und Goldstein haben entdeckt, dass der zugrunde liegende Mechanismus der schweren erblichen familiären Hypercholesterinämie ein vollständiger oder teilweiser Mangel an funktionellen LDL-Rezeptoren ist. Bei normalen Personen hemmt die Aufnahme von Cholesterin aus der Nahrung die zelleigene Synthese von Cholesterin. Als Folge wird die Anzahl der LDL-Rezeptoren auf der Zelloberfläche verringert. Dies führt zu erhöhten Cholesterinspiegeln im Blut, die sich in der Folge in Arterienwänden ansammeln und Arteriosklerose und schließlich einen Herzinfarkt oder Schlaganfall verursachen können.“
Beachten Sie, dass erbliche Störungen nicht die einzige Ursache für die Herunterregulierung von LDL-R sind: "LDL-Rezeptoren werden durch erhöhtes zelluläres Cholesterin herunterreguliert, um eine Sterinstauung zu verhindern, die ein Merkmal von Zellen in atherosklerotischen Läsionen ist." Aus: Biochemistry of Lipids, Lipoproteins and Membranes (Sixth Edition), 2016
Die Art und Weise, wie Sie Ihre Frage stellen, macht darauf aufmerksam, dass es keine entsprechende Herunterregulierung des HDL-Rezeptors gibt.
Suche auf Wikipedia nach „HDL-Rezeptor“ ergibt: „Die Seite „HDL-Rezeptor“ existiert nicht.“ Vermutlich keine triviale Erkenntnis, dass die Nobelpreisträger Goldstein und Brown eine ganze Familie sogenannter „ Scavenger-Rezeptoren “ entdeckten.
Was würde passieren, wenn die HDL-Rezeptoren herunterreguliert würden (im Vergleich zur LDL-Herunterregulierung)?
Der "molekulare Unterschied" erscheint dann überraschend unklar: Sowohl HDL als auch LDL tragen Cholesterin (es ist dasselbe Molekül in HDL und LDL). Wenn zu viel LDL zu einer Ablagerung von Cholesterin führt, kann die gleiche Ablagerung durch ("zu viel") HDL erfolgen - insofern ist Ihre Frage berechtigt. Die Herunterregulierung des Rezeptors unterscheidet LDL von HDL.
Es gibt eine Antwort auf eine verwandte Frage auf Stackexchange, die in Bezug auf die unterscheidende Rolle von Apo B100 genau zu passen scheint, Zitat: „Weil LDL nur das ApoB-Protein enthält, wird es weniger leicht erkannt. Daher verweilt mehr LDL im Blut.", mit weiterem Hinweis auf die pathologischen Wirkungen. Wenn es einen anderen (unterscheidenden) molekularen Mechanismus als die Apo-Protein-Signalgebung gäbe, der vermutlich transportierte Lipide vor Oxidation oder Abbau schützt, wäre er erwähnt worden. Apo-B100 macht den Unterschied.
Das wesentliche molekulare Merkmal von LDLs ist der LDL-Rezeptor-Ligand Apo B-100, der an LDL-Rezeptoren (auf Zellen des Fettgewebes) im Gegensatz zu HDL-Rezeptor-Liganden an HDL-Rezeptoren (auf Leberzellen, überraschenderweise jedoch) bindet , nicht nur auf Leberzellen) - letztere bekannt als "Scavenger-Rezeptor Klasse B Typ I"
was in Wikipedia kaum erwähnt wird (zugegebenermaßen ohne intensive Suche: Es sollte in der Literatur keine Diskussion oder gar Erwähnung über die Herunterregulierung gefunden werden, die eine häufige Krankheit verursacht, vgl. Rigotti et al. , 1997, A targeted mutation in the murine gene encoding der High Density Lipoprotein (HDL)-Rezeptor-Scavenger-Rezeptor Klasse B Typ I offenbart seine Schlüsselrolle im HDL-Stoffwechsel: „(...) hepatic overexpression senkt dramatisch das Plasma-HDL.“ – wobei nur das Knock-out-Experiment, um das es in dieser Arbeit geht, Anlass dazu gibt Herunterregulierung Vermutlich gibt es keine Herunterregulierung des HDL-Rezeptors, die einer Herunterregulierung des LDL-Rezeptors entsprechen würde.
Zu Apo B-100 als charakteristischem molekularem Marker siehe z. B. Encyclopedia Britannica :
„LDL enthält ein einzelnes Apoprotein und ist der Hauptträger von Cholesterin zum peripheren Gewebe, sowohl als freies Sterol als auch als Ester. Die Abgabe des Lipidgehalts dieses Komplexes erfordert die Erkennung des LDL B-100-Apoproteins durch einen Rezeptor, der sich auf dem LDL-B-100-Apoprotein befindet Oberfläche der Empfängerzellen. Wenn das Protein an den Rezeptor gebunden ist, wird der Rezeptor-LDL-Komplex von der Zelle in einem als Endozytose bekannten Prozess verschlungen. Das endozytierte LDL gibt seinen Inhalt innerhalb der Zelle ab und B-100 wird zu freiem Amino abgebaut Säuren, die zur Synthese neuer Proteine verwendet oder als Energiequelle verstoffwechselt werden. Die Aufklärung des Prozesses der zellulären Aufnahme von LDL durch Michael Brown und Joseph Goldstein brachte ihnen 1985 den Nobelpreis für Physiologie oder Medizin ein."
Es gibt noch einen weiteren Aspekt zu Ihrer Frage im Zusammenhang mit dieser Antwort.
Der Begriff „Scavenger“ (für HDL, nicht LDL) weist darauf hin, dass ein weiterer Unterschied zwischen HDL und LDL darin besteht, dass LDL nach Aufnahme (durch Fettgewebszellen) in Lysosomen abgebaut wird, während HDL nach „Aufsetzen“ recycelt wird HDL-Rezeptor, dh nicht einmal von Leberzellen aufgenommen. Lassen Sie mich bitte diesen vorläufigen Gedanken hinzufügen: Da es also keine "Feedback"-Schleife für LDL zu geben scheint; die Leber, die LDL produziert (die übrigens als sogenannte VLDL beginnen), reguliert möglicherweise die LDL-Synthese nicht herunter, wenn das Zielgewebe LDL-Rezeptoren herunterreguliert.
Sie können die folgenden weiteren versuchsweisen Gedanken von mir überspringen: Laut Voet et al., Biochemistry, führt die Aufnahme von LDL über LDL-Rezeptoren durch Adipozyten dazu, dass diese Cholesterin „verschütten“ (das anscheinend von HDL „aufgefangen“ wird). Siehe zum Beispiel Verghese et al., 2007
"In Gegenwart von HDL, bestehend aus humanem ApoA-I und Phosphatidylcholin, setzen Adipozyten Cholesterin in einer Lipoproteindosis- und zeitabhängigen Weise frei." Dies könnte als Recycling von Cholesterin angesehen werden (von der Leber in das Speichergewebe durch LDL und wieder zurück in die Leber durch HDL gebracht, da die Abgabe von Fettsäuren an das Speichergewebe es diesen ermöglicht, Cholesterin freizusetzen). In einem evolutionären Versuchskonzept könnte Cholesterin als Molekül an sich einst das eigentliche Transportvehikel gewesen sein, um Lipide und Fette von und zu Zellen zu transportieren (siehe oben: HDL wird nicht einmal endozytiert, ganz im Gegensatz zur LDL-Rezeptor-Aufnahme, wenn es kehrt zu den Leberzellen zurück, dennoch tritt Cholesterin in die Leberzellen ein. HDL verlässt den empfangenden "Abfangrezeptor" so wie es ist; es ist ein Taxi; meine Analogie ist zu Cholesterin). Diese Idee führt dazu, die schiere Menge an geladenem Cholesterin als vermutlich charakteristisch zu betrachten: Jede Menge, die ein Niveau überschreitet, das als obere Grenze für die "Taxifunktion" definiert ist, kann entladen (oder in der Reinigungsfunktion oxidiert) werden. Dies scheint mit der Existenz von "Überresten" vereinbar zu sein: Es gibt LDL- oder VLDL-Überreste und Chylomikronen-Überreste, durch die die Leber Cholesterin erhält. Auf molekularer Ebene kann es einen Unterschied in der relativen oder absoluten Cholesterinmenge zwischen LDL und HDL geben, was widerspiegelt, dass HDL als solches ein Überbleibsel in dem Sinne ist, dass es Cholesterin in „Überrestmenge/also Qualität“ recycelt. (Es gibt LDL- und Chylomikronenreste, jedoch gibt es keinen Begriff oder etwas wie HDL-Rest, um dies zu überprüfen). Übrigens wird Cholesterin entgegen der Intuition wohl als " Cholesterin durch LDL-Rezeptor-Signalisierung. "Auf der anderen Seite" nehmen diese Zielzellen von LDL Cholesterin und Lipide (aus LDL-Abbau) "auf" - und halten -. Es könnte eine Rückkopplungsschleife geben, bei der Lipide aufgenommen und freies Cholesterin abgegeben werden, die - in der Evolution - immer noch unabhängig von der APO-B100-LDL-Rezeptorsignalisierung ist, und die Herunterregulierung des LDL-Rezeptors allein könnte beide Ebenen miteinander verbinden oder freie "Cholesterine" regulieren. im Blut oder, wenn Cholesterin ein früheres Aufnahmeinstrument ist, wie vorgeschlagen, in interstitieller Flüssigkeit. Vielen Dank, dass Sie dieses zaghafte Denken zugelassen haben. Es könnte eine Rückkopplungsschleife geben, bei der Lipide aufgenommen und freies Cholesterin abgegeben werden, die - in der Evolution - immer noch unabhängig von der APO-B100-LDL-Rezeptorsignalisierung ist, und die Herunterregulierung des LDL-Rezeptors allein könnte beide Ebenen miteinander verbinden oder freie "Cholesterine" regulieren. im Blut oder, wenn Cholesterin ein früheres Aufnahmeinstrument ist, wie vorgeschlagen, in interstitieller Flüssigkeit. Vielen Dank, dass Sie dieses zaghafte Denken zugelassen haben. Es könnte eine Rückkopplungsschleife geben, bei der Lipide aufgenommen und freies Cholesterin abgegeben werden, die - in der Evolution - immer noch unabhängig von der APO-B100-LDL-Rezeptorsignalisierung ist, und die Herunterregulierung des LDL-Rezeptors allein könnte beide Ebenen miteinander verbinden oder freie "Cholesterine" regulieren. im Blut oder, wenn Cholesterin ein früheres Aufnahmeinstrument ist, wie vorgeschlagen, in interstitieller Flüssigkeit. Vielen Dank, dass Sie dieses zaghafte Denken zugelassen haben.
Um zusammenzufassen:
Lipoproteine ähneln einander in der Molekularstruktur und den transportierten Formen von Fett/Cholesterin mehr, als die Akronyme HDL/LDL vermuten lassen.
Der relevante Unterschied liegt in ihren Liganden, die unterschiedliche Zielzellen adressieren: Ligand an „LDL-Rezeptor“ (den HDL nicht oder in viel geringerem Maße zu haben scheint) ist entscheidend für die Pathogenität, da es zu einer „LDL-Rezeptor-Herunterregulierung“ kommt; es gibt keine physiologische (in vivo) HDL-Herunterregulierung.
Molekulares Unterscheidungsmerkmal scheint somit das Apo-B100-Molekül zu sein, das das größte Protein des Körpers ist.
Peter Bernhard
Schicksal von Acetyl-CoA im gut ernährten Zustand?
Wie würde ein Medikament dazu führen, dass man ein anderes Gewicht behält?
Ist es möglich zu verhindern, dass mehr/zusätzliches Fett im Körper gespeichert wird?
Können Bakterien Fettsäuren zu Treibstoff umwandeln?
Was sind die Unterschiede zwischen den Carnitinformen?
Warum fehlt Glycerolkinase in Adipozyten, ist aber in der Leber vorhanden?
Was passiert, wenn wir überschüssiges Fett essen?
Was ist die molekulare Grundlage von Kater?
Warum wird LPL (Lipoprotein-Lipase) während des Fastens herunterreguliert?
Was ist in IDL (Lipoprotein mittlerer Dichte) enthalten?
Benutzer1323