Was macht den Unterschied zwischen ionischen und kovalenten Bindungen?
KeithS
Hintergrundgeschichte: Als ich etwas über chemische Reaktionen erfuhr, gab es zwei Arten von molekularen Bindungen: Ionische, bei denen ein Atom oder Verbindungsmolekül mit einer niedrigen Wertigkeitszahl diese Valenzelektronen an eine oder mehrere andere Verbindungen mit einer hohen Wertigkeitszahl verliert, die es verbindet sich dann mit; und kovalent, wo Valenzelektronen zwischen zwei oder mehr Atomen "geteilt" werden, die ihre Elektronen nicht tatsächlich an das andere Atom "aufgeben" wollen.
Zunächst hat das funktioniert. Aber dann, als ich beiläufig auf Wikipedia und anderen Seiten herumstöberte, um mein Wissen zu erweitern, fand ich Beweise, die diese klare Trennung widerlegten. Zum Beispiel besagt die Erklärung des pH-Werts auf Wikipedia, dass reines flüssiges Wasser, eine Substanz, die ein Lehrbuchbeispiel für kovalente Atombindungen ist, nicht wirklich kovalent ist, sondern eine gleiche Mischung aus Hydronium (H 3 O + ) und Hydroxid (OH - ) Ionen. Die Erklärung ist, dass sich flüssiges Wasser als polares Lösungsmittel tatsächlich selbst auflöst und Wasserstoffionen (nackte Protonen) relativ frei zwischen Wasseratomen in flüssigem und sogar gasförmigem Zustand wandern und Hydronium bilden, wo das Wasserstoffatom gewonnen wird, und Hydroxid, wo es ist verloren.
Ein anderes Beispiel; Benzol. Es besteht aus 6 Kohlenstoffen und 6 Wasserstoffen. Kohlenstoff möchte vier Elektronen bekommen, um seine äußere Valenzschale zu füllen. Der Wasserstoff füllt einen, angeblich durch Teilen. Die anderen drei erhält es, indem es Elektronen mit seinen beiden Nachbarn teilt. Nun, drei Elektronen teilen sich nicht durch zwei; Klassischerweise wird uns beigebracht, dass sich die Doppel- und Einfachbindungen abwechseln, aber das Verhalten dieses Konstrukts zeigt tatsächlich, dass das letzte Valenzelektron jedes Kohlenstoffatoms selbst von seinen beiden Nachbarn geteilt wird, wodurch jedem Kohlenstoff "eineinhalb" Bindungen verliehen werden mit einem seiner Nachbarn. Das klingt nach „Teilen“, aber nicht so, wie es normalerweise beschrieben wird.
Nun, es gibt andere ziemlich konkrete Beispiele für Kovalenz; zweiatomige Gasmoleküle wie O 2 und N 2 haben jeweils eine größtenteils volle Valenzschale und wollen nur ein paar mehr Valenzelektronen, und so "zieht" jedes Atom in seinen zweiatomigen Bindungen die Valenzelektronen des anderen in seine eigene Valenzschale, ohne seine eigene zu verlieren . Aber "hochkovalente" Bindungen wie diese scheinen eher eine Ausnahme von der Regel als eine Regel für sich zu sein.
Also frage ich vielleicht von einer tieferen Ebene aus: Wo ist die "Trennlinie" zwischen Bindungen, die als "ionisch" bezeichnet werden, und Bindungen, die als "kovalent" bezeichnet werden? Gibt es eine primäre Eigenschaft der Bindung oder der resultierenden Substanz, die als Beweis dafür dienen kann, definitiv zu sagen „das ist eine(n) _ __ _ __ Bindung?“ Oder gibt es tatsächlich eine „Grauzone“, wo das Verhalten von Elektronen zwischen Atomen liegt könnten beide Wege gleichzeitig beschrieben werden?
Antworten (3)
genth
Die Kluft ist eigentlich nicht zwischen kovalent und ionisch, sondern ein Spektrum zwischen lokalisierten und delokalisierten Elektronen. Die Geschichte von all dem ist eigentlich ziemlich faszinierend, und Phil Anderson hat in seinem Buch „More and Different“ ein nettes Kapitel dazu. Zu der Zeit, als die Menschen begannen, sich ernsthaft mit Quantenmechanik an Molekülen zu beschäftigen, gab es im Wesentlichen zwei Denkrichtungen, die dominierten.
Auf der einen Seite war Mott und allgemeiner Hund und Pauli, die dachten, Elektronen seien in erster Linie an Atome gebunden und durch elektromagnetische Wechselwirkungen würden ihre Bewegungen/Orbitale deformiert und man würde Moleküle bekommen. Diese Version wird normalerweise im Chemieunterricht gelehrt, da es mit ein paar Faustregeln möglich ist, eine Vielzahl von Verhaltensweisen qualitativ zu berücksichtigen.
Auf der anderen Seite träumte Slater von einer Maschine, die einfach die elektronische Struktur berechnen konnte, indem sie ihr die Atome und Elektronen gab. In diesem Bild werden die Elektronen in erster Linie als über alle Atome delokalisiert gedacht, und durch ein strenges Verfahren der Störungstheorie fügt man den Effekt von Wechselwirkungen zwischen Elektronen hinzu und kann eine beliebig gute Genauigkeit erreichen.
Letzteres hat das Problem, dass die Ergebnisse nicht intuitiv sind – es gibt keine Faustregeln und man wird auf einfaches Rechnen reduziert. Das Problem bei Ersterem ist, dass die "Faustregeln" zum Erreichen einer hohen Genauigkeit äußerst komplex werden und nicht wirklich sehr einfach zu verwenden oder zu berechnen sind - es fehlt die einfache Regelmäßigkeit der Slater-Traummaschine. Es ist bezeichnend, dass letzteres im Wesentlichen gewonnen hat, und heutzutage ist es Routine, die elektronische Struktur ziemlich großer Moleküle (~ 1000 Atome) durch Brute-Force zu berechnen (die Technik ist als Dichtefunktionaltheorie bekannt, und es gibt kommerzielle Software dafür). Tu es).
In endlichen Molekülen kann man tatsächlich zeigen, dass im Prinzip beide Ansätze funktionieren – technisch sprechen wir von einer adiabatischen Verbindung zwischen den lokalisierten und delokalisierten Zuständen. Der einzige praktische Unterschied besteht darin, wie schwer es ist, die Berechnungen durchzuführen. Bei unendlichen Molekülen (z. B. festen Kristallen) ist dies jedoch nicht der Fall, und es kann einen richtigen Phasenübergang zwischen den beiden Ausgangspunkten geben. In diesem Fall entspricht der lokalisierte Ansatz dem, was heutzutage phantasievoll als "stark korrelierte Systeme" bezeichnet wird, wie Mott-Isolatoren und magnetisch geordnete Materialien, und der delokalisierte Ansatz sind im Wesentlichen Metalle (Fachsprache: renormiert zu einer Fermi-Flüssigkeit).
Heutzutage gibt es den Wunsch (von theoretischen Festkörperphysikern), den lokalisierten Ansatz erneut zu entwickeln, da es möglich sein könnte, einige nützliche Faustregeln für magnetische Materialien zu finden, von denen ein prominentes Beispiel die Hochtemperatur-Supraleiter sind.
DilithiumMatrix
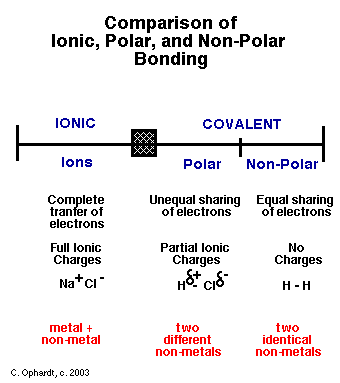
Gute Frage. Bindungen sind definitiv ein Spektrum zwischen kovalent (wo Elektronen ungefähr zu gleichen Teilen geteilt werden) und ionisch (wo eine Spezies die Kontrolle über die Elektronen dominiert). Manchmal wird der Begriff „polar kovalent“ irgendwo dazwischen geworfen. Es gibt keine klare Trennlinie, aber im Allgemeinen ist die interessierende Größe die Polarität des resultierenden Moleküls. Hochpolar ist charakteristisch für eine ionische Bindung, während wenig (oder keine) Polarität charakteristisch für kovalente Bindungen ist.
Was die Polarität bestimmt, ist der Unterschied in der Elektronegativität zwischen den Atomen, die die Bindung bilden.
Auf dieser Webseite finden Sie viele gute Informationen zu diesem Thema: http://www.chemistry.mcmaster.ca/esam/Chapter_7/section_1.html
Manisherde
Sie haben vollkommen recht, es gibt keine Trennlinie.
Elektronegativität
Für kovalente Bindungen haben wir etwas, das als Elektronegativität bekannt ist .

In diesem (reinen gasförmigen) HCl-Molekül gibt es eine kovalente H-Cl-Bindung. Denken Sie daran, dass eine Bindung im Grunde eine Elektronenwolke ist. Nun hat Chlor eine hohe Elektronegativität (sprich: Affinität zu Elektronen) und die Form der Elektronenwolke ist in Richtung Chlor verzerrt. Somit wird HCl, eine kovalente Verbindung (in gasförmigem Zustand), zu einer teilweise ionischen Verbindung. Wenn Sie es in Wasser legen, sind die intramolekularen Kräfte groß genug (und stabil genug ist), dass es in Ionen zerfällt.
Asymmetrische kovalente Bindungen haben also ein wenig ionischen Charakter. Die Elektronen sind nicht perfekt geteilt, eines der Moleküle nimmt sie in Beschlag.
Polarisation
Andererseits haben wir für überwiegend ionische Verbindungen etwas, das Polarisation genannt wird . In Ionenkristallgittern haben die positiven und negativen Ionen im Idealfall schöne runde Wolken. Aufgrund von Größen-/Ladungsunterschieden können diese Wolken jedoch auch verzerrt sein, was zu einer kleinen Überlappung führt. Überlappung = kovalente Bindung, also haben wir jetzt einen teilweise kovalenten Charakter in einer ionischen Bindung.
Grobe Idee
Eine Möglichkeit, sie grob voneinander zu unterscheiden, sind Fajans Prinzipien (IIRC ausgesprochen ohne das „J“).
Sie haben vielleicht bemerkt, dass Polarisation und Elektronegativität ziemlich dasselbe sind, nur an entgegengesetzten Extremen.
OK, jetzt ein paar Dinge zu Ihren Beispielen:
Wasser
Reines Wasser ist nicht nur Ionen. Es geht nur um Mol von jedem pro Liter Wasser. Der Rest ist schlicht, gebunden .
Benzol
Benzolkohlenstoffe teilen die Elektronen nicht nur mit ihren nahen Nachbarn. All die Elektronen werden geteilt.

Hier werden alle Elektronen der Doppelbindungen (sechs davon) in die zweilappige Wolke geworfen, die Sie im Diagramm sehen. Elektronenwolken sind quantenmechanische Objekte, und daher sagen sie nur: "Es gibt eine xyz-Wahrscheinlichkeit, hier ein Elektron zu finden". Und das Elektron könnte von jedem der Kohlenstoffe stammen, IIRC, es gibt kein Unterscheidungsmerkmal (Quantenzahl), das Ihnen sagt, von welchem Kohlenstoff diese stammen - es muss einige andere Quantenzahlen geben, aber ich weiß es nicht - aber sie werden es tun wahrscheinlich zufällig und nicht mit dem Kohlenstoffatom verwandt.
LLang
Spin-1212\frac{1}{2}-Teilchen in der Chemie
Was sind physikalische Gründe für chemische Reaktionen? [geschlossen]
Elektrische Dipolübergänge/Erwartungswert der Position
Rechnen mit Quantenzahlen und Form von Knotenschalen
Notation für elektronische Zustände von Molekülen
H2+-Ion: Welche Elemente der Hamilton-Matrix verschwinden aufgrund von Symmetrie?
Was ist die Beziehung zwischen dem Van-der-Waals-Radius und der Van-der-Waals-Länge?
Haben quantenverknüpfte Ringe aus Quantenknoten Energie?
Auswahlregeln in der Rotationsspektroskopie - Wassermolekül
Bindungswinkel – H2O vs. CO2
Henry
David z